Fundo
Juglone, um composto pure de naftoquinona, exibe potente atividade anticancerígena, mas enfrenta limitações clínicas devido à baixa solubilidade, baixa biodisponibilidade e toxicidade sistêmica. Embora as estratégias de ativação de drogas responsivas ao microambiente tumoral ofereçam uma solução promissora, conseguir um controle espacial preciso sobre a conversão de precursores não tóxicos em agentes citotóxicos continua sendo um desafio significativo.
Métodos
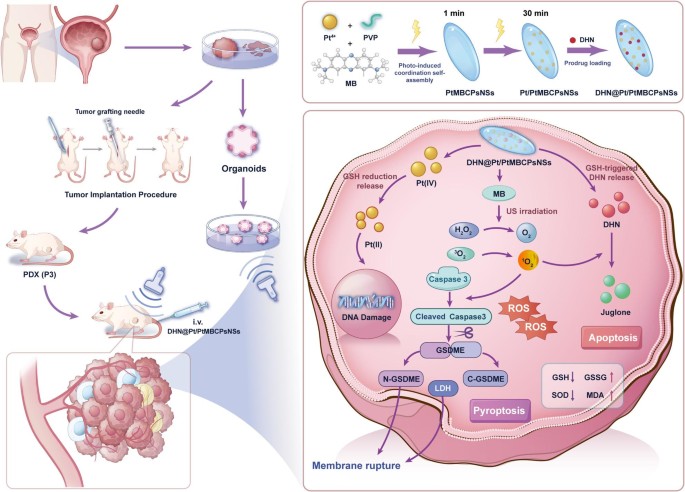
Desenvolvemos DHN @ Pt / PtMBCPsNSs, um sonosensibilizador em nanoescala à base de platina (Pt) – azul de metileno (MB), para permitir a síntese de juglona sob demanda acionada por ultrassom em tumores. O sistema foi avaliado em modelos de câncer de bexiga, incluindo linhas celulares, organoides derivados de pacientes (PDOs) e modelos de xenoenxerto tumoral derivado de pacientes (PDX), avaliando a captação tumoral, distribuição intracelular, modulação de hipóxia (“H2Ó2-O2-¹O2“cascata), marcadores de estresse oxidativo (SOD, GSH, MDA, GSSG) e vias de morte celular (apoptose/piroptose). O sequenciamento do transcriptoma foi realizado para elucidar os mecanismos moleculares.
Resultados
Os DHN@Pt/PtMBCPsNSs foram internalizados pelas células UMUC-3 e T24 e acumulados principalmente nos compartimentos mitocondriais. Os componentes à base de platina esgotaram cataliticamente o GSH através do ciclo redox. DHN@Pt/PtMBCPsNSs desencadeou a produção de O2 e ¹O2 após irradiação native dos EUA, aliviando a hipóxia e convertendo seletivamente dihidroxinaftaleno (DHN) em juglona em tumores, o que reduz a toxicidade sistêmica da juglona. O nanossistema interrompeu ainda mais o equilíbrio redox celular, desencadeando o esgotamento das defesas antioxidantes (SOD e GSH) e reduzindo a proporção de GSH/GSSG. Experimentos com células in vitro e experimentos com PDOs demonstraram que DHN@Pt/PtMBCPsNSs combinados com irradiação dos EUA podem inibir significativamente a proliferação de células cancerígenas da bexiga, induzir a apoptose e common a piroptose através da by way of de sinalização caspase 3/GSDME mediada por ROS. No modelo PDX, os DHN@Pt/PtMBCPsNSs acumularam-se no native do tumor e inibiram significativamente o crescimento do tumor sob irradiação dos EUA.
Conclusões
Como um novo sonosensibilizador e indutor de piroptose, os DHN@Pt/PtMBCPsNSs alcançam um efeito sinérgico preciso da quimioterapia e da terapia sonodinâmica dentro das células, ao mesmo tempo que minimizam os efeitos adversos nas células normais e superam as limitações associadas aos agentes quimioterápicos naturais. Esta abordagem pode avançar na tradução clínica de agentes anticancerígenos naturais.
Resumo gráfico